【理科のコツ】水よう液(中和)
テーマ:酸性・アルカリ性と中和反応
酸とアルカリの中和とは?──「塩と水」ができる発熱反応をイメージでつかもう
酸性とアルカリ性を混ぜると「中性になる」=中和……と覚えていませんか?
実は、中和の本当の中身は「酸性とアルカリ性が互いの性質を打ち消し合う反応」です。
発熱反応・塩(えん)と水の生成・リトマス紙の変化まで、入試で差がつくポイントをまとめました。
水溶液・気体・燃焼なども含めた化学分野の整理は、全体像はこちらでまとめて確認できます。個別に伸ばし方を設計したい場合は、中学受験理科の個別指導(オンライン対応)講座一覧 をご覧ください(体験あり)。
動画で学ぶ:水溶液の混ぜ合わせと中和のイメージ
まずは動画で「酸性」「アルカリ性」「中和」のイメージをつかんでから、
下のまとめとクイズで知識を整理していきましょう。
1. 中和とは何か?──「性質を打ち消し合う」反応
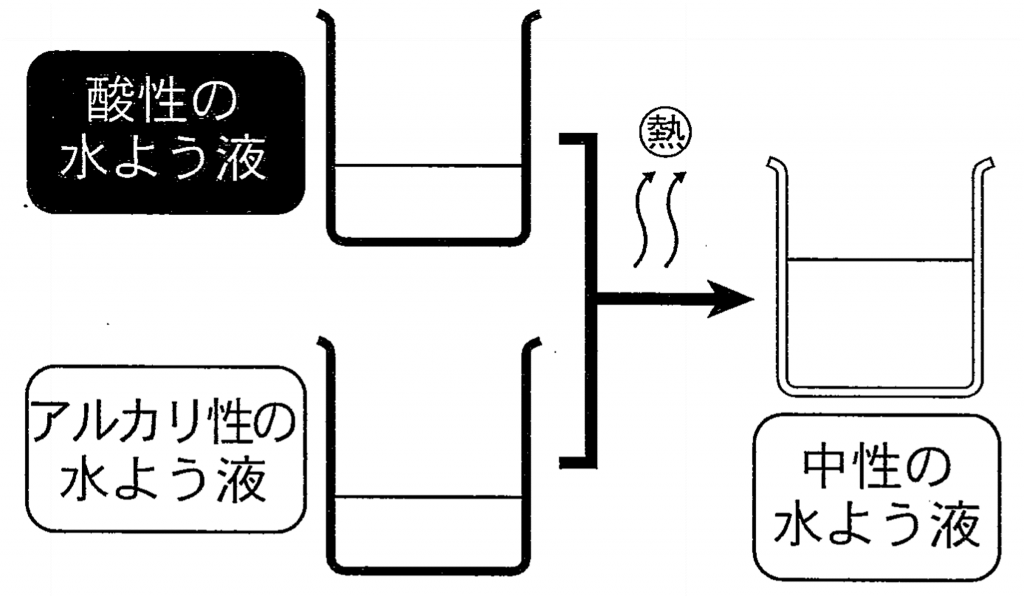
教科書などでは、酸性の水溶液とアルカリ性の水溶液を混ぜて中性になることを
中和として説明していることが多いですが、これは「完全中和」の場合です。
本来の定義としては、
- 酸性の性質とアルカリ性の性質が互いに打ち消し合う反応が「中和」。
- 混ぜたあとに、少し酸性が残っていても/少しアルカリ性が残っていても、性質を打ち消し合っていれば中和とみなされる。
中学入試では、特に酸性とアルカリ性がちょうど互角になって中性になる「完全中和」の状態がよく出題されます。
(1)中和は必ず「発熱反応」になる
中和の図には、さりげなく「熱」と書かれていることがあります。これはとても重要なポイントで、
中和反応は必ず発熱反応です。
- 酸性の水溶液とアルカリ性の水溶液を混ぜると、ビーカーが温かくなる。
- これは吸熱ではなく「発熱」であることをおさえておく。
- 中学受験ではあまり問われませんが、知っておくと理解度が一段上がるポイントです。
2. 中和でできるもの──塩(えん)と水

中和反応をまとめると、つくづく大事なのはこの一言です。
酸 + アルカリ(塩基) → 塩(えん) + 水
- 塩(えん)と書いて、「しお」だけを指すわけではない。
- 食塩(塩化ナトリウム)のほか、硫酸銅などさまざまな塩がある。
- 「酸」と「アルカリ」の組み合わせによって、できる塩の種類が変わる。
つまり、中和反応では、かならず「塩」と「水」ができるというパターンをまず覚えましょう。
(1)入試で大事な視点:濃度と量
問題を解くときにカギになるのが、酸性・アルカリ性の濃さ(濃度)と体積(量)です。
- 酸のほうが濃いなら、アルカリをたくさん用意しないと完全中和にならない。
- 逆にアルカリが強くて濃いなら、酸を多めに入れる必要がある。
- 問題文の「○倍にうすめた」「何mLずつ入れた」などの条件から、どちらが勝つか・完全中和かを読み取る。
「濃度 × 体積」で「強さ × 量」をイメージしながら、どちらの陣営が勝つかを考えると整理しやすくなります。
3. リトマス紙の変化と語呂合わせ「おかあさん」
中和・酸・アルカリを学ぶときにセットで覚えておきたいのが、リトマス紙の色の変化です。
| 溶液の性質 | 青色リトマス紙 | 赤色リトマス紙 |
|---|---|---|
| 酸性 | 青 → 赤 | 赤のまま |
| アルカリ性 | 青のまま | 赤 → 青 |
| 中性 | 青のまま | 赤のまま |
しゅん吉流キーワードは「おかあさん」です。
- おかあさん = 「青(お) → 赤(あ)= 酸(さん)」
- 青い紙が赤に変わったら酸性! とセットで覚える。
語呂合わせのおかげで、テスト本番で一瞬で思い出せるのがポイントです。
もし自分なりの語呂が思いついたら、ぜひノートに書いて覚えましょう。
4. 中和反応の仕組みまとめ
| 項目 | 内容 |
|---|---|
| 中和反応とは? | – 酸性とアルカリ性が互いの性質を打ち消し合う反応 – 完全中和:酸性とアルカリ性が互角になり、中性になる状態 – 中和反応では必ず発熱反応になり、熱が発生する |
| 生成物 | – 中和反応でできるもの:塩(えん)と水 – 塩には食塩(塩化ナトリウム)だけでなく、硫酸銅などさまざまな化学物質が含まれる |
| リトマス紙の変化 | – 青色リトマス紙 → 赤色:酸性 – 語呂合わせ:おかあさん(青 → 赤 = 酸性) – 赤色リトマス紙 → 青色:アルカリ性 |
| 問題のポイント | – 酸性・アルカリ性の濃度(こさ)と体積(量)を見て、どちらが余るか判断する – 中和の結果、酸性またはアルカリ性が少し残る場合もある – 入試では完全中和の条件(中性になる点)をねらう問題が多い |
5. 中和反応の仕組みクイズ(10問)
中和の定義・発熱・生成物・リトマス紙…どこまで定着したかチェックしてみましょう。
各問題の「正解を見る」ボタンを押すと答えが表示され、ボタンは消えます。
| 問題 | 選択肢 | 正解を見る |
|---|---|---|
| 1. 中和反応とはどのような反応ですか? | A. 酸性がアルカリ性を打ち負かす反応 B. 酸性とアルカリ性が互いの性質を打ち消し合う反応 C. アルカリ性が酸性を蒸発させる反応 D. 酸性とアルカリ性が共存する反応 |
|
| 2. 中和反応で必ず発生するものは? | A. 吸熱 B. 冷気 C. 発熱 D. 色変化 |
|
| 3. 中和反応で生成されるのは? | A. 酸素と水 B. 塩と水 C. 塩と酸素 D. 水だけ |
|
| 4. 中和で生成される「塩」とは何ですか? | A. しお(食塩)のみ B. 塩酸の成分 C. 食塩以外の化学物質も含む D. 水酸化物のみ |
|
| 5. 酸性のリトマス紙の色変化は? | A. 赤→青 B. 青→赤 C. 緑→赤 D. 青→緑 |
|
| 6. リトマス紙の語呂合わせ「おかあさん」とは何を指しますか? | A. 赤→青: アルカリ性 B. 青→赤: 酸性 C. 緑→青: 中性 D. 赤→緑: 酸性 |
|
| 7. 完全中和の定義は? | A. 酸性とアルカリ性が互いに中和しきる状態 B. 酸性が強く残る状態 C. アルカリ性が勝つ状態 D. 中和が不完全な状態 |
|
| 8. 中和反応で塩が生成される理由は? | A. 酸がアルカリ性を溶かすから B. 酸とアルカリの化学反応で塩ができる C. 水の蒸発による副産物 D. 温度の影響で生成 |
|
| 9. 中和反応における「発熱反応」の特徴は? | A. 必ず冷たくなる B. 必ず熱が発生する C. 時々熱が発生する D. 無反応 |
|
| 10. 中和反応の例として正しいものは? | A. 水と油 B. 酸性とアルカリ性 C. 酸素と窒素 D. 塩と水 |
6. まとめ──「酸+アルカリ=塩と水+発熱」をワンセットで
- 中和=酸性とアルカリ性が互いの性質を打ち消し合う反応。完全中和では中性になる。
- 中和では必ず発熱反応が起こり、ビーカーがあたたかくなる。
- 中和反応の生成物は、塩(えん)と水が基本パターン。
- リトマス紙は「おかあさん」= 青 → 赤 で酸性と覚えると、テストで迷いにくい。
- 計算問題では、酸とアルカリの濃度 × 体積を比べて、どちらが余るかを判断する。
このページの内容をおさえておくと、中和・中性・発熱・リトマス紙の色の変化が1本の線でつながります。
ノートに自分なりの図や語呂合わせを書き加えながら、何度か解き直してみましょう。
中和・水溶液がニガテな人へ──しゅん吉クエストの理科講座
「酸性・アルカリ性」「中和」「イオン」…水溶液の単元は、仕組みをつかめると一気に楽しくなります。
受験理科専門塾しゅん吉クエストでは、
動画+演習問題で「なぜそうなるか」から丁寧に解説しています。
- 小学生〜中学生向けの中和・水溶液特集講座
- オンライン個別指導での質問し放題プラン
- 他教科とのセット受講も相談可能
詳しいカリキュラム・料金・体験授業については、公式サイトをご覧ください。


